
Bảng Tính Tan Hoá Học Đầy Đủ Của Muối, Axit Và Bazo Dễ Nhớ
Bảng tính tan hoá học là phần không thể thiếu trong bộ môn Hóa học lớp 8, 9, 10, 11. Chúng bao gồm những kiến thức về chất kết tủa, chất bay hơi, chất không tan trong nước... Tuy nhiên với nhiều thông tin như vậy sẽ rất khó trong phần ghi nhớ đối với các bạn học sinh. Bài viết dưới đây sẽ giúp bạn nắm chắc kiến thức và cách học thuộc bảng tính tan dễ nhất nhé.
1. Bảng tính tan là gì?
Bảng tính tan là bảng gồm các hàng và các cột; trong đó cột là các Cation kim loại còn hàng là các Anion gốc Axit (OH-). Để xác định được trạng thái của 1 chất, ta sẽ xác định Ion dương và Ion âm, sau đó sẽ gióng theo hàng và cột tương ứng.
2. Định nghĩa về độ hòa tan
Độ hòa tan hay độ tan cho thấy khả năng hòa tan của một chất ( rắn, lỏng, khí ) trong dung môi để tạo thành một chất bão hòa trong nhiệt độ nước.
Với đặc trưng ở trên có thể xác định được chất tan hay không tan dựa vào thông tin sau:
- Nếu lấy trên 10g chất đó có thể hòa tan được trong 100g nước hòa tan thì chất này được gọi là chất tan hay chất dễ tan
- Nếu chỉ dưới 1g chất đó được hòa tan trong 100g nước thì đó là chất ít tan
- Nếu chỉ có 0,01 chất đó được hòa tan trong 100g nước thì chúng được gọi là chất không tan
Tính tan của Axit, Bazo và Muối
Ở trong nước, thường sẽ có chất tan và chất không tan, chất tan ít và chất tan nhiều.
- Tính tan của Axit: Hầu hết các Axit tan được trong nước, trừ Axit Silixic.
- Tính tan của Bazo: Các Bazo không tan trong nước, trừ một số Bazo như NaOH, KOH,...
- Tính tan của Muối: Những muối Natri, Nitrat, Kali đều tan; các muối Clorua, Sunfat tan được. Phần lớn các muối Cacbonat lại không tan.
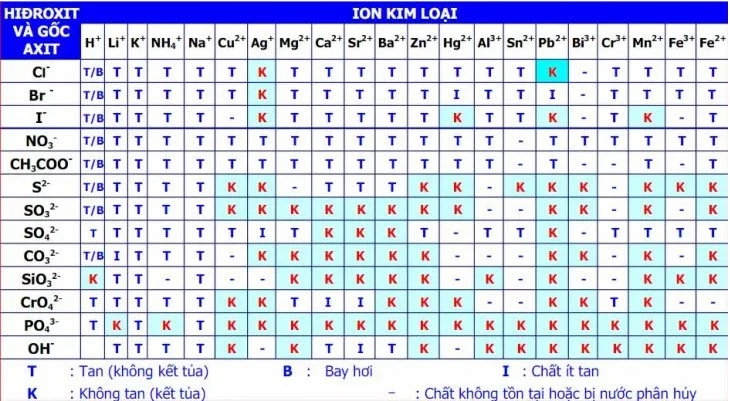
3. Bảng tính tan hóa học đầy đủ của Muối, Axit và Bazo
Bảng tính tan hóa học bao gồm rất nhiều kiến thức và cả những quy tắc. Do vậy mà việc ghi nhớ kiến thức này không hề dễ dàng. Theo đó, các bạn hãy tra cứu chi tiết thông tin trong đó để chủ động giải và xử lý những bài toán về hóa học hay khi làm các thí nghiệm.
Để giải những bài toán hóa học về tính tan, kết tủa hay sự bay hơi trong phòng thí nghiệm thì học sinh cần phải có được phiếu tính tan. Do vậy, những kiến thức trong bảng tính tan đầy đủ thì bạn cần phải nắm rõ.
HIDROXIT và GỐC AXITION KIM LOẠIH+Li+K+NH4+Na+Cu2+Ag+Mg2+Ca2+Sr2+Ba2+Zn2+Hg2+Al3+Sn2+Pb2+Bi3+Cr3+Mn2+Fe3+Fe2+Cl-T/BTTTTTKTTTTTTTTK-TTTTBr-T/BTTTTTKTTTTTITTI-TTTTI-T/BTTTT-KTTTTTKTTK-TK-TNO3-T/BTTTTTTTTTTTTT-TTTTTTCH3COO-T/BTTTTTTTTTTTTT-T--T-TS2-T/BTTTTKK-TTTKK-KKK-KKKSO32-T/BTTTTKKKKKKKK--KK-K-KSO42-TTTTTTITKKKT-TTK-TTTTCO32-T/BTTTT-KKKKKK---KK-K-KSiO32-KTTTT--KKKKK-K-K--KKKCrO42-TTTTTKKTIIKKK--KKTK--PO43-TKTKTKKKKKKKKKKKKKKKKOH-TTTTK-KTITK-KKKKKKKKGiải thích bảng tính tan:
I : Chất Ít tan
K : Không tan ( Kết tủa )
T : Tan ( Không kết tủa )
- : Chất không tồn tại hoặc bị nước phân hủy
B : Bay hơi
4. Các yếu tố ảnh hưởng đến độ tan của một chất
Tính hóa tan của một chất có tác động của nhiều yếu tố, do vậy các bạn cần phải nắm được thông tin sau đây:
4.1. Nhiệt độ
- Đối với chất khí, độ tan của nó sẽ tỷ lệ nghịch với nhiệt độ khi trong dung môi. Người ta thường đun nóng chất khí để loại bỏ những chất như CO2 và O2 ra khỏi dung môi mà không làm biến đổi cũng như làm phân hủy chất. Đồng thời còn giúp được dược chất ổn định.
- Chất rắn thu nhiệt thì khi nhiệt độ càng cao khiến cho độ hòa tan càng lớn. Còn với chất rắn tỏa nhiệt khi hòa tan thì ngược lại nhiệt độ càng giảm, độ tan sẽ càng tăng.
4.2. Áp suất (đối với chất khí)
- Như các bạn học hóa đã biệt, trong định luật Henry, nếu các chất khí có độ tan nhỏ và áp suất không quá cao thì khi tăng áp suất trên bề mặt chất lỏng không đổi thì lượng chất khí hòa tan trong một thể tích chất lỏng xác định cũng sẽ tăng. Và ngược lại.
4.3. Độ phân cực của chất tan và dung môi
- Các chất phân cực cũng thường dễ tan hơn trong môi trường dung môi phân cực cụ thể như kiềm, nước, dung dịch muối hay axit vô cơ,…
- Những chất ít phân cực cũng sẽ dễ tan môi trường dung môi hữu cơ kém phân cực bao gồm chloroform, benzene, toluene, dicloromethan,…
4.4. Dạng thù hình
- Thường loại chất rắn dạng vô định hình sẽ có độ tan lớn hơn so với chất rắn dạng tinh thể trong cùng một môi trường dung môi. Đó là bởi khi chất rắn ở dạng kết tinh thì sẽ có cấu trúc mạng lưới tinh thể tương đối bền vững. Bởi vậy mà nó cần nhiều năng lượng để có thể phá vỡ cấu trúc hơn. Ngược lại thì chất rắn dưới dạng vô định hình sẽ không ổn định như dạng tinh thể, chúng có xu hướng chuyển sang dạng tinh thể.
4.5. Hiện tượng hydrat hóa
- Trong quá trình kết tinh, chất rắn thường có thể được tồn tại dưới dạng ngậm nước hoặc dạng khan. Đối với dạng ngậm nước, chất rắn ở dạng khan sẽ có tính tan lớn hơn.
4.6. Hiện tượng đa hình
- Với môi trường kết tinh khác nhau sẽ tạo điều kiện để chất rắn tồn tại dưới các dạng tinh thể khác nhau bao gồm Hydrat, đồng kết tinh, .. cùng với những tính chất vật lý và độ tan trong dung môi không giống nhau. Thường với những tinh thể kém bền vững thì sẽ đòi hỏi ít năng lượng trong phá vỡ cấu trúc do vậy mà dễ tan hơn.
4.7. Độ pH của dung dịch
- Khi kiềm hóa dung môi, axit yếu sẽ có độ tan tăng lên
- Nếu axit hóa dung môi, độ tan của các chất kiềm yếu sẽ tăng lên
- Đối với những chất lưỡng tính, độ tan của các chất này giảm dần khi mà độ pH càng gần điểm đẳng điện và ngược lại.
4.8. Chất điện ly
Độ tan của các chất tan có thể bị giảm trong chất điện ly trong dung dịch do vậy bạn cần phải lưu ý pha loãng chất điện ly trước khi hòa vào dung dịch.
4.9. Các ion cùng tên
Trường hợp nồng độ của các ion cùng tên tăng lên, có thể làm cân bằng điện ly của chất tan thì sẽ làm chuyển dịch về hướng phân tử ít tan và làm giảm đi độ tan của chất. Bởi vậy mà trong quá trình hóa tan, bạn cần phải tiến hành với những chất ít tan trước, sau đó mới đến những chất dễ tan.
4.10. Hỗn hợp dung môi
Nếu như bạn kết hợp các hỗn hợp dung môi đồng tan cùng với nước cụ thể như glycerin-ethanol-nước thì sẽ làm tăng độ tan của những chất khó tan.
5. Cách đọc bảng tính tan dễ dàng
Bảng tính tan hóa học lớp 9 bao gồm các cột và các hàng các bạn có thể tìm hiểu dễ dàng trong sách giáo khoa. Trong đó, cách đọc bảng tính tan là theo hàng gồm anion gốc axit (OH-) còn cột là các cation kim loại. Một số chất cụ thể, người ta có thể xác định được ion âm và ion dương, chúng được xếp theo hàng và cột tương ứng giúp bạn nắm được trạng thái của chất đó.
6. Cách học thuộc nhanh bảng tính tan nhanh nhất
Đối với các môn khoa học như Hóa học thì điều quan trọng đó là các bạn cần phải luyện tập và làm nhiều bài tập để rèn luyện về tính ghi nhớ cũng như điều kiện hòa tan của các hợp chất. Như vậy sẽ giúp cho các bạn tìm hiểu sâu hơn về bản chất của những phản ứng hóa học, đồng thời dễ dàng ghi nhớ tính tan đối với những chất thường gặp trong bảng tính tan.
Mặc dù vậy thì việc ghi nhớ toàn bộ bảng tính tan chảy cũng sẽ gặp nhiều khó khăn và dễ bị nhầm lẫn. Các bạn chuyên hóa thường truyền tai nhau những mẹo và cách học bảng tính tan nhanh nhất và hiệu quả nhé:
6.1. Thực hành thường xuyên
Một trong những cách học bảng tính tan lớp 9 và lớp 11 nhanh nhất đó chính là phải thực hành lặp đi lặp lại. Nếu bạn được học trong môi trường tốt thì sẽ có điều kiện được thường xuyên thực hành môn hóa học sẽ rất tốt.
Điều cốt lõi đối với môn hóa học đó là bạn phải nắm được bản chất của các phản ứng hóa học. Điều này được thể hiện rõ hơn khi bạn tận mắt chứng kiến các điều kiện, phản ứng xảy ra nếu làm trong phòng thí nghiệm.
Đồng thời các bạn cần phải kết hợp với việc làm nhiều bài tập về nhà, việc thực hành nhiều sẽ giúp bạn nắm được tính chất tan của một số chất thường dùng. Bạn sẽ dần quen thuộc với bảng tính tan các muối hay của các chất khác và dễ nhớ hơn hơn nhiều khi được lặp lại thường xuyên.
Những kiến thức hóa học thường gặp nhiều trong chương trình THPT, đây là nền tảng để bạn vận dụng vào cuộc sống. Nhất là với những bạn học tại các trường Đại học, Cao đẳng Y Dược HCM thì vận dụng nhiều trong quá trình học và sau khi đi làm. Nó sẽ giúp bạn đảm nhiệm tốt các công việc chuyên môn và có cơ hội thăng tiến trong cuộc sống.
6.2. Cách ghi nhớ bảng tính tan bằng hình ảnh

Bảng tính tan bao gồm một lượng kiến thức không nhỏ và chúng rất dễ gây nhầm lẫn với nhau. Đây cũng là những kiến thức nền tảng của môn hóa học., do vậy các bạn cần phải có phương pháp và thái độ học tập chuyên tâm. Nếu chỉ học vẹt, học một cách vô thức thì chỉ ghi nhớ được những thứ trước mắt, rất dễ quên nếu không thường xuyên vận dụng. Một trong những cách học bảng tính tan của các chất đó là thông qua hình ảnh.
Đây là cách học không hề mới lạ được áp dụng trong nhiều bộ môn khác nhau, điển hình là ghi nhớ. Nhiều chứng minh cho thấy, thị giác có tác động lớn tới não bộ với khả năng ghi nhớ của con người. Bởi vậy mà thông qua hình ảnh cũng là biện pháp giúp bạn ghi nhớ bảng tính tan các chất.
6.3. Học thuộc các quy tắc rút gọn về tính tan
Độ tan của muối, axit, bazo trong nước vừa được chia sẻ ở trên, bạn có thể ghi nhớ tính tan của các chất này trong nước. Cụ thể như:
6.3.1. Đối với muối:
- Các muối có gốc halogen như -Br, -Cl, -F… thì đều có khả năng tan trong nước.
- Muối gốc Sunfit (SO3), Silicat (SiO3), Cacbonat (CO3) hay Sunfua (S) đều sẽ khó tan, thậm chí không tan trong nước. Tuy nhiên, nếu các gốc này kết hợp với kim loại có tính kiềm thì chúng sẽ tạo ra những hợp chất muối tan được trong nước.
- Ngoài ra, một số kim loại kiềm bao gồm Na, K, Li… sau khi kết hợp thành muối thì chúng đều có thể tan trong nước. Nhìn vào bảng tính tan hóa có thể thấy các hàng có chứa kim loại tính kiềm, ký hiệu bằng chữ T, tức là các chất dễ tan.
- Muối gốc Sunfat (SO4) đa số đều tan trong nước, trừ muối sunfat của kim loại bari không tan.
Lưu ý: Một số muối không tồn tại hoặc chúng có thể bị phân huỷ ngay trong nước thì trong bảng tính tan được ký hiệu bằng dấu “-“. Các trường hợp này không nhiều nhưng cũng gần phải ghi nhớ nhé.
6.3.2. Đối với axit và bazo:
- Mọi loại axit đều tan dễ dàng trong nước, tuy nhiên có H2CO3 sẽ dễ bị phân huỷ trong nước và các axit có gốc silicic như H2SiO3, H4SiO4… thì không tan.
- Các bazo thì đa số không tan trong nước, ngoại trừ bazo của kim loại kiềm như Li, K, N đều tan trong nước và bazo của kim loại nhóm 2 sẽ ít tan trong nước.
6.4. Học thuộc bảng tính tan qua thơ
6.4.1. Bài thơ Tính tan của muối
Loại muối tan tất cả
là muối ni tơ rat
Và muối a xê tat
Bất kể kim loại nào
Những muối hầu hết tan
Là clorua, sunfat
Trừ bạc chì clorua
Bari, chì sunfat
Những muối không hoà tan
Cacbonat, photphat
Sunfua và sunfit
Trừ kiềm, amoni.
6.4.2 Bài thơ tính tan của các chất hóa học
Bazơ, những chú không tan:
Đồng, nhôm, crôm, kẽm, mangan, sắt, chì.
Ít tan là của Canxi
Magiê cũng chẳng điện ly dễ dàng
Muối kim loại I đều tan
Cũng như Nitrat và “nàng” hữu cơ
Muốn nhớ thì phải làm thơ!
Ta làm thì nghiệm bây giờ thử coi,
Kim Loại I, ta biết rồi,
Những kim loại khác ta “moi” ra tìm
Photphat vào nước “đứng im” (Trừ kim loại I)
Sunphat một số “im lìm trơ trơ”:
Bari, chì với S - r
Ít tan gồm bạc, “chàng khờ” Canxi,
Còn muối Clo - rua thì Bạc đành kết tủa, anh chì cố tan (Giống muối Br, I)
Muối khác thì nhớ dễ dàng:
Gốc S O 3 chẳng tan chút nào! (Trừ kim loại I)
Thế còn gốc S thì sao? (Giống muối cacbonat)
Nhôm không tồn tại chú nào cũng tan
Trừ đồng, thiếc, bạc mangan,
Thủy ngân, kẽm, sắt không tan cùng chì
Đến đây thì đã đủ thi,
Thôi thì chúc bạn trường gì cũng vô!
Với kiến thức về bảng tính tan trên đây hi vọng sẽ là hành trang giúp các bạn học tập tốt môn Hóa. Nếu yêu thích, đam mê ngành Y Dược thì đừng bỏ lỡ trường Cao đẳng Y Khoa Phạm Ngọc Thạch nhé.
Link nội dung: https://cce.edu.vn/bang-tinh-tan-hoa-hoc-day-du-cua-muoi-axit-va-bazo-de-nho-a12973.html